热烈祝贺迈驰合作伙伴已有36家兽药企业通过GMP认证
精选【导读】热烈祝贺迈驰合作伙伴已有36家兽药企业通过GMP认证- 本文有2523个文字,大小约为8KB,预计阅读时间7分钟。
国家严防严管严控食品安全风险,保证广大人民群众吃得放心安心。食品安全问题已经成为社会关注的焦点。随着多个重大食品安全问题的曝光,我国的食品质量安全监管力度不断加大,近年来食品质量安全情况已经有了很大改善,整体情况呈现“稳中向好”的格局。但是目前依然面临着超范围与超限量使用添加剂、兽药残留不符合标准、重金属污染等风险。为了进一步改善我国的食品质量安全状况,把好入口食品质量关至关重要。新GMP兽药改革在这里应运而生。
在正式解读新版兽药GMP之前,迈驰在这里先恭喜我们已经顺利通过GMP认证的企业。迈驰合作兽药企业200+,目前通过认证企业截止发稿前有36家(河北锦坤动物药业、南京福斯特牧业、江西纵横生物、广东广牧、广州天科、广东粤海、海大集团、广州和生堂、南海禅泰、广东粤海、广州中冠动物药业、华农高科等36家兽药企业已成功通过GMP认证)。未来迈驰会做所有的客户的坚强后盾,把好的服务带给大家。

为什么大部分的兽药企业都选择迈驰:
(1)我们做粉散剂生产项目很有很多案例,有经验。我司是国内最早一批包装兽药产品的公司,特别是兽药粉散预混剂我司已经积累了广泛的兽药客户

(2)我司在广州和合肥都有工厂,全国都有售后服务人员,可以保证全国各地售后服务。我司非常重视售后和品牌,已经投入了大量的人力物力确保设备长期稳定运行和售后。
(3)设备质量稳定,有广大兽药客户使用,设备性价比高。设备电气元器件使用高配置、材料厚度保证质量,材质满足兽药抗腐蚀性要求。
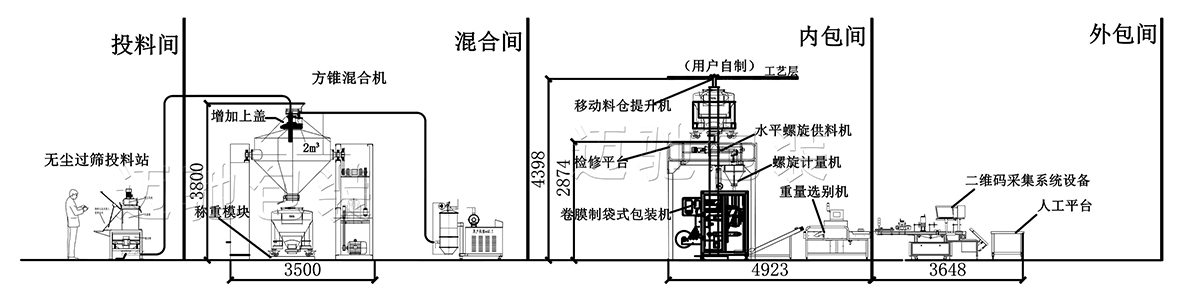
(4)广州迈驰对于分装前后端的设备对接,整线配套有案例和经验。广州迈驰不仅仅生产分装设备,前后端的设备对接也有很多成功案例,比如投料、混合、分装、采集二维码、自动装箱开箱等环节连接,我们可以做到整线顺畅连接
有很多人对这次的2020年农业农村部发布《兽药生产质量管理规范(2020年修订)》(以下简称“新版兽药GMP”)仍然持有观望态度。这里为大家解析一下:
1.什么是兽药GMP
2.新版兽药GMP在哪些方面进行了修订完善?
3.新版兽药GMP什么时候开始施行?有哪些实施要求?
什么是兽药GMP?
答:兽药生产质量管理规范(简称“兽药GMP”)是兽药生产管理和质量控制的基本要求和准则,是世界各国对兽药生产全过程监督管理普遍采用的法定技术规范。兽药生产是一个十分复杂的过程,涉及许多环节和管理,任何一个环节疏忽都有可能导致产品质量问题。为加强兽药生产质量管理,2002年,原农业部颁布实施了兽药GMP。通过实施兽药GMP,从人员、厂房、设备、物料、文件、生产过程、产品销售、自检等全过程、全方位规范兽药生产行为,确保兽药产品质量安全,对促进兽药行业健康发展、维护动物产品质量安全发挥了重要作用。
新版兽药GMP在哪些方面进行了修订完善?
答:新版兽药GMP实施后将有效遏制低水平重复建设,提高产业集中度,提升产品质量控制水平,更好地保障动物源食品安全和公共卫生安全。修订内容主要涉及以下四个方面。
一是优化结构,细化内容,提高指导性和可操作性。新版兽药GMP共13章287条,而原兽药GMP仅95条。各章分节编写,对各项要求尽可能细化,便于使用者理解掌握。同时,根据不同类型兽药的生产工艺和特点,同步制定了无菌兽药、非无菌兽药、兽用生物制品、原料药、中药制剂等5类兽药生产质量管理的特殊要求,对正文部分的原则性规定进一步细化,增强指导性和可操作性。
二是提高准入门槛,遏制低水平重复建设。在硬件方面,提高了净化要求和特殊兽药品种生产设施要求。参考欧盟和我国药品生产质量管理规范对无菌制剂空气洁净度级别的要求,将无菌兽药和兽用生物制品生产环境净化设置为A、B、C、D四个级别,增加了生产环境动态监测,对厂房建设和净化设备显著提高了要求。对高生物活性的特殊兽药生产,要求使用专门的生产车间、设备及空调净化系统,并与其他兽药生产区严格分开。在软件方面,提高了企业质量管理要求。引入质量风险管理、变更控制、偏差处理、纠正和预防措施、产品质量回顾分析、持续稳定性考察计划、设计确认等制度,最大限度保证兽药产品质量。在人员方面,提高了企业关键管理人员应当具备的资质和技能要求。
三是提高企业生物安全控制要求,确保生物安全。对兽用生物制品生产、检验中涉及生物安全风险的厂房、设施设备以及废弃物、活毒废水和排放空气的处理等,进一步提出了严格要求。有生物安全三级防护要求的兽用生物制品的生产设施需符合生物安全三级防护标准,检验设施需达到生物安全三级实验室标准。
四是完善责任管理机制,压实相关责任。明确企业负责人是兽药质量的主要责任人。将原兽药GMP规定的生产管理部门和质量管理部门承担的职责分别明确到生产管理负责人和质量管理负责人,为追究兽药产品质量事故责任人提供依据。
新版兽药GMP什么时候开始施行?有哪些实施要求?
答:新版兽药GMP将于2020年6月1日起施行。近期农业农村部发布公告,公布了实施要求和过渡期具体安排。根据公告,所有兽药生产企业均应在2022年6月1日前达到新版兽药GMP要求;未达到新版兽药GMP要求的兽药生产企业(生产车间),其兽药生产许可证和兽药GMP证书有效期最长不超过2022年5月31日。自2020年6月1日起,新建兽药生产企业以及兽药生产企业改、扩建或迁址重建生产车间,均应符合新版兽药GMP要求。自2020年6月1日起,省级畜牧兽医主管部门受理兽药生产企业按照新版兽药GMP要求提出的申请,经检查验收符合要求的,兽药生产许可证和兽药GMP证书有效期为5年;受理兽药生产企业到期换证并按照2002年发布的兽药GMP要求提出的申请,经检查验收符合要求的,兽药生产许可证和兽药GMP证书有效期核发至2022年5月31日。对2020年6月1日前已经受理的申请,按原规定完成相关工作并核发兽药生产许可证和兽药GMP证书,证书有效期核发至2022年5月31日。
GMP认证已经国外发达国家实行了数十年的历史,对食品、药品的工艺和质量等多方面有管理和规范的重要作用,是产品安全和质量的重要保障。新修订的GMP认证也将很多小企业挡在兽药生产门槛之外,有助于提高我国兽药企业的整体质量,有助于监管,更有助于兽药质量的提高。
近年来,国家及行业对药品生产企业的质量要求不断加强与提升,越来越多的企业已经成功拿到了新版GMP认证证书。不断的督促企业持续升级硬件要求、软件管理及质量理念,在挑战中把握机遇,以更热情饱满的精神状态迎接未来的挑战,为兽药行业的健康规范发展做出贡献。
手机阅读更方便:热烈祝贺迈驰合作伙伴已有36家兽药企业通过GMP认证
看完觉得不错?专业工程师在线为您服务!
在线咨询版权声明
本文链接地址:热烈祝贺迈驰合作伙伴已有36家兽药企业通过GMP认证http://www.mcpack.cn/news/gsxw/419.html,转载请注明出处
相关资讯
-

广州迈驰:全场景兽药包装机械领跑者
浏览次数: 次
-

恭喜广州天科动保使用广州迈驰兽药包装机通过新版GMP认证
浏览次数: 次
-

热烈祝贺迈驰合作伙伴【广州和生堂动物药业】顺利通过新版兽
浏览次数: 次
-

热烈祝贺迈驰合作伙伴——江西纵横生物顺利通过新版GMP要求认
浏览次数: 次
-

热烈祝贺迈驰合作伙伴【华农高科】顺利通过新版GMP验收
浏览次数: 次
-

迈驰合作伙伴-河北锦坤动物药业有限公司新厂汇丰通过新版兽药
浏览次数: 次
-

迈驰包装助力新版GMP认证,只需这款兽药中药粉包装机就可搞定
浏览次数: 次
-

兽药粉剂包装机认证新版兽药GMP多少钱?
浏览次数: 次
-

买你们的兽药包装机辅助通过GMP认证吗
浏览次数: 次
-

选购兽药包装机就到广州迈驰
浏览次数: 次
猜你需要
热门必看
最新资讯

 中文
中文 英文
英文







 粤公网安备 44011302004150号
粤公网安备 44011302004150号







 13902302343
13902302343
